Devido à complexidade e falhas no processo de desenvolvimento de novos medicamentos inovadores, as empresas enfrentam riscos reais de perdas de investimento. Por outro lado, estes altos investimentos na busca de uma nova entidade química (NEQ) podem ser recompensados pela propriedade intelectual e a exclusividade de mercado oferecido pelo novo produto que estará disponível no portfólio da empresa desenvolvedora por aproximadamente 10 anos. De fato, para ser uma empresa vencedora neste contexto é necessária estratégia suportada por novas tecnologias e conhecimento altamente especializado.
Segundo o Dr. Rodolpho C. Braga, cientista de dados e especialista em desenvolvimento de novos fármacos da Altox Ltda, a inovação é um pilar para o crescimento e competitividade da indústria farmacêutica e veterinária. Hoje, o custo para o desenvolvimento de um novo fármaco pode ultrapassar, de acordo alguns estudos, 2,6 bilhões dólares. Esse valor de investimento é reflexo de vários desafios técnicos, regulatórios e econômicos enfrentados nos pipelines de Pesquisa, Desenvolvimento e Inovação (PD&I).
Como exemplo de rentabilidade no setor farmacêutico de inovação radical, o medicamento HUMIRA (adalimumab) da empresa farmacêutica AbbVie Inc., faturou mais de 16 bilhões de dólares em 2016. Além disso, perdas financeiras mais elevadas ocorrem nas falhas em estágios posteriores a fase pré-clínica. Imaginemos que um medicamento falhe durante a fase clínica III, o custo envolvido em uma falha nesse estágio do desenvolvimento, resultaria em uma perda de 70% (cerca de 1,8 bilhão de dólares) de todo o valor investido em PD&I (Tabela 1).
Fase | Gasto (milhões de Dólares) | Fatia (%) |
Pré-humana/Pré-clínica | 11.272,7 | 21,2 |
Fase I | 4.722,0 | 8,9 |
Fase II | 5.697,8 | 10,7 |
Fase III | 15.264,4 | 28,7 |
Aprovação | 2.717,7 | 5,1 |
Fase IV | 8.827,0 | 16,6 |
Não categorizada | 4.751,5 | 8,9 |
Gasto total em PD&I | 53.253,1 | 100 |
Tabela 1. Custo com PD&I em 2014 nos Estados Unidos.
Neste cenário, a Altox apresenta linhas de serviços in silico para o setor de PD&I farmacêutico e veterinário, focados na fase pré-clínica de inovação radical ou incremental. A criação de compostos radicais faz parte um pipeline complexo e longo (8 a 12 anos), que envolve equipes multidisciplinares e altamente qualificadas. Desenvolvemos ferramentas computacionais (in silico) focadas em endpoints estratégicos, utilizando abordagens modernas de quimioinformática, as quais englobam métodos como o QSAR (Quantitative Structure-activity Relationship), inteligência artificial, machine learning, deep learning, Docking e FEP (Free Energy Perturbation). A tecnologia implementada nos nossos modelos de inteligência artificial faz o uso de fingerprint 2D e fingerprint farmacofórico 3D, atendendo as necessidades específicas de diversos projetos.
Nossas abordagens são consideradas métodos alternativos, pois minimizam e racionalizam a utilização de testes tradicionaus in vitro e in vivo de atividade, seletividade e ADME/tox, não utilizando animais. Algumas vantagens das metodologias alternativas são:
- Economia de dinheiro e recursos para avaliar o potencial bioativo de novas moléculas, evitando a síntese de moléculas que potencialmente irão falhar nos estágios iniciais do desenvolvimento.
- Economia de tempo e de recursos para otimização hit-to-lead e lead-optimisation, visando priorizar compostos com propriedades superiores, resultando em ciclos de otimização mais rápidos.
- Diminui consideravelmente o risco de falhas dos projetos através da avaliação off-target e de propriedades ADME/tox indesejáveis, nos estágios iniciais do desenvolvimento.
SOLUÇÕES EM INOVAÇÃO RADICAL E INCREMENTAL
- Otimização hit-to-lead e lead-optimisation
Inteligência artificial
Possuímos mais de 1200 modelos de inteligência artificial para endpoints enzimáticos e fenotípicos visando auxiliar otimização da potência de novos inibidores. Além disso, criamos modelos de inteligência artificial on-demand exclusivos para projetos de clientes.
Estabilidade molecular e de ligação
Conseguir uma ligação potente da pequena molécula no alvo molecular, mantendo uma série de propriedades necessárias para segurança e eficácia biológica, é o principal objetivo na descoberta de novos fármacos. Durante as últimas décadas, os cálculos de energia livre se beneficiaram de campos de força aprimorados e algoritmos de amostragem, bem como do advento da computação paralela de baixo custo. Tais desenvolvimentos permitiram que os cálculos de energia livre consigam a precisão, confiabilidade, facilidade de uso para otimização de compostos líderes na pesquisa química e farmacêutica a nível industrial, facilitando melhores decisões para a síntese de análogos.
- Segurança Farmacológica e Terapêutica
A segurança farmacológica e toxicológica é avaliada através das características físico-químicas, biológicas e estruturais, por meio de ferramentas in silico. A figura 1 apresenta um painel experimental consolidado de ADME/Tox da fase pré-clínica. Nesse contexto, foram desenvolvidos modelos computacionais para 80% dos ensaios desse painel (LogD, Solubilidade, permeabilidade Caco-2 e PAMPA, metabolismo hepatócitos, metabolismo, inibição e indução de enzimas CYPs, hERG, painel toxicológico …) estão destacados na figura 1.

Figura 1. Painel experimental ADME/Tox bem estabelecido para fase pré-clínica na PD de novos fármacos (Adaptado de ADMET & DMPK 1(3) (2013) 19‐28).
- Optimização multiparamétrica
Os estudos de optimização multiparamétrica visam realizar modificações estruturais nas moléculas, para encontrar as melhores propriedades estruturais (potência, seletividade e propriedades ADME/Tox), antes mesmo delas serem sintetizadas.
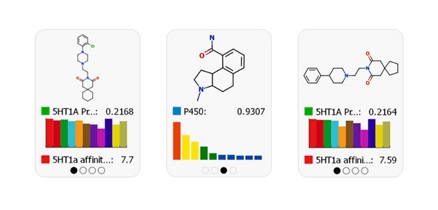
Figura 2. Visualização do perfil multiparamétrico para facilitar a seleção dos compostos com propriedades superiores.
Mecanismo de ação e alvo molecular (reposicionamento)
O Reposicionamento de fármacos é uma estratégia de inovação incremental menos dispendiosa e ao mesmo tempo lucrativa. Existem várias estratégias de reposicionamento como: novas indicações terapêuticas, novas formas farmacêuticas, combinações de fármacos, dentre outras. Nesse contexto, a Altox oferece diferentes abordagens para propor uma lista de “target compounds”, nesse caso de fármacos já aprovados ou órfãos, e que não estão mais protegidos por Patente de Invenção (PI).
- Quimiogenômica para identificação de moléculas capazes de se ligarem com alvos biológicos, através da utilização de sequências biológicas primárias contidas no genoma humano.
- Similaridade 3D e inteligência artificial para identificar o alvo molecular através da busca e descoberta do perfil de comportamento molecular de moléculas biomiméticas através da similaridade do ambiente químico e biológico.
- Estimação da afinidade de ligação (afinidade e seletividade) das moléculas identificadas anteriormente pelo método de FEP.



