A Agência Nacional de Vigilância Sanitária publicou em 2021 o “Guia sobre o Controle de Nitrosaminas em Insumos Farmacêuticos Ativos e Medicamentos”(Guia nº 50/2021 – versão 1), que reune um conjunto de recomendações e etapas para avaliação de risco, confirmação e determinação de limites aceitáveis para N-nitrosaminas em medicamentos.
Segundo a agência, trata-se de instrumento regulatório não normativo, de caráter recomendatório e não vinculante, sendo, portanto, possível o uso de abordagens alternativas às proposições dispostas, desde que compatíveis com os requisitos relacionados ao caso concreto.
As recomendações locais e internacionais para análise e redução do risco de exposição a nitrosaminas estão centralizadas em duas etapas, com comunicação ao regulador ao final destas etapas a depender os resultados. A primeira etapa é a análise do risco de presença de nitrosaminas (neste caso, risco teórico ou potencial), e a segunda etapa, a confirmação do risco (risco realístico).
Com uma orientação quanto à ordem de prioridades na análise de risco portfólio, consideram-se como fatores dose máxima diária, duração do tratamento, indicação terapêutica e população de pacientes tratados. Uma maior prioridade deve ser atribuída a produtos com alta dose máxima diária, posologia prolongada (uso crônico), indicações terapêuticas de menor risco (fora do escopo do ICH S9 ou sem ativos per si com potencial mutagênico), medicamentos isentos de prescrição ou com indicações pediátricas.
Recentemente, além de produtos sintéticos, a EMA (European Medicines Agency) incluiu critérios para avaliação de produtos biológicos, sobretudo, aqueles com fragmentos sintéticos, embalados com blisters contendo nitrocelulose ou nos quais há emprego de agentes nitrosantes.
As diretrizes da EMA/369136/2020 são extremamente úteis, por outro lado, apontaremos neste texto, como em termos práticos, a organização destas etapas e a tomada de decisão baseada em risco são relevantes, e podem resultar em melhor custo-efetividade.
Etapa 1 – Análise de Risco (Risk evaluation)
A primeira etapa está focada na análise do risco potencial de presença de nitrosaminas (traduzido preferencialmente desta forma, para que não seja confundida com uma avaliação de risco – Toxicological Risk Assessment), por formação ou contaminação. Ou seja, a resposta desta etapa está voltada para definir se há ou não risco de presença de nitrosaminas, e adicionalmente, pode envolver predições teóricas de formação e uso de knowledge-based para apontamento de estruturas de possíveis nitrosaminas que podem auxiliar a etapa seguinte.
Risco de formação e de contaminação
Até o momento, algumas vias de formação e contaminação estão sendo propostas com base nas experiências anteriores, e muito conhecimento novo tem sido produzido. Um importante aspecto que vem sendo considerado na avaliação de relevância de uma formação teórica é não apenas o tipo de amina disponível quimicamente e o nível de susceptibilidade, mas o pKa da amina específica e o quanto é favorável a formação na condição e etapa específica (ex: pH e temperatura) em que há contato com o agente nitrosante. Neste sentido, o nível de conhecimento sobre o processo sintético e o auxílio do especialista em química orgânica são essenciais para análises verdadeiramente robustas.
Risco de formação de nitrosaminas = Presença de agente nitrosante ou oxidante + Amina susceptível/vulnerável (secundária ou terciária) ou sais quaternários de amônio + Condição e etapa favorável
Risco de contaminação por nitrosaminas = Potenciais fontes de nitrosaminas ou contaminação por agentes susceptíveis à formação até a etapa de armazenamento do produto acabado em sua vida útil.
Algumas questões podem ser úteis na análise do risco de presença de nitrosaminas no IFA e no produto acabado:
- Existe uma amina vulnerável na estrutura do IFA e das impurezas de processo conhecidas?
- Existe risco de formação de N-nitrosaminas no processo sintético, considerando a combinação de reagentes, solventes, catalisadores, materiais de partida, intermediários formados, impurezas e degradantes formados em etapas específicas? O carreamento é plausível?
- Existe risco potencial de contaminação (ex: materiais recuperados, como reagentes, solventes, catalisadores, materiais de partida, intermediários, impurezas e degradantes, equipamento etc.) ou carreamento e interação de agentes inter-etapas? O carreamento é plausível?
- Existe risco de ocorrência de nitrosamina durante a fabricação do produto acabado ou ao longo do armazenamento na vida útil do produto? A formulação (excipientes e suas impurezas), o perfil de degradação, ou tipo de embalagem sugere risco de formação?
- Dado o panorama de possíveis causa-raiz, há risco de presença de nitrosaminas?
Ferramentas clássicas de análise de risco (aplicadas inclusive no contexto do gerenciamento de risco de qualidade) podem ser extremamente úteis para auxiliar na quantificação de risco, ponderando-se em matriz os diferentes fatores de risco identificados, possibilitando a identificação de prioridades segundo a plausibilidade, relevância e dano potencial.
O report EMA/369136/2020 estabelece que após a análise do risco de formação, deve ser conduzida a análise confirmatória, para a detecção de N-nitrosaminas, e neste sentido, havendo detecção, as medidas de controle e mitigação de riscos devem ser estabelecidas.
Classicamente, a experiência em avaliação de risco nos aponta que pode não ser uma estratégia efetiva fazer a interface entre “análise de risco de presença” de N-nitrosamina (ou potencial de exposição teórica), e uma “confirmação do risco” por meio de análises (potencial de exposição real), sem dimensionar se uma determinada N-nitrosamina faz parte do grupo de “coorte de alta preocupação”ou trata-se de uma N-nitrosamina de menor preocupação toxicológica, ou ainda, da plausibilidade da impureza ocorrer no estágio final de obtenção do IFA ou no produto acabado. As estratégias de controle são focadas no risco de uma N-nitrosamina mutagênica e com potencial carcinogênico.
Antes da etapa de confirmação de risco (etapa analítica), no entendimento da Altox, é considerado muito importante avaliar o potencial de toxicidade das N-nitrosaminas potencialmente formadas e apontadas no estudo teórico, para se ter uma ideia do horizonte analítico a ser colocado como meta e com mais elementos para o delineamento e priorização da etapa de confirmação experimental. Algumas N-nitrosaminas poderão ser consideradas não-mutagênicas, e conforme últimas recomendações da EMA controladas como impurezas comuns (conforme critérios do ICH Q3A/B), enquanto que outras deverão ser controladas em limites muito restritivos de acordo com a potência. No provável cenário de haver pouco detalhamento das etapas sintéticas ou ocorrência de vários produtos com algum nível de risco “de presença”, o perfil toxicológico é essencial para apontar prioridades e nível de esforços da etapa confirmatória.
Mais do que o mero uso automatizado de modelos in silico, um profundo domínio de métodos de estudos de Relação Estrutura-atividade (SAR) será necessário, para avaliar a interferência dos grupamentos R1 e R2 (e outros), com a verificação de grupamentos antenuadores, neutros ou de potenciação da resposta mutagênica e carcinogênica. Conforme o racional proposto pela EMA, o uso de modelos de relação estrutura-atividade (SAR) validados podem ser muito úteis na avaliação toxicológica. Modelos com descritores estruturais adequados para detecção destes padrões e ferramentas de inspeção visual podem ser bastante úteis neste contexto. Na figura abaixo, pelo Mapa de Probabilidade, é possível identificar nas estruturas de nitrosaminas grupamentos capazes de atenuar ou cessar (em verde) ou manter/potencializar a atividade mutagênica da nitrosamina (em vermelho).
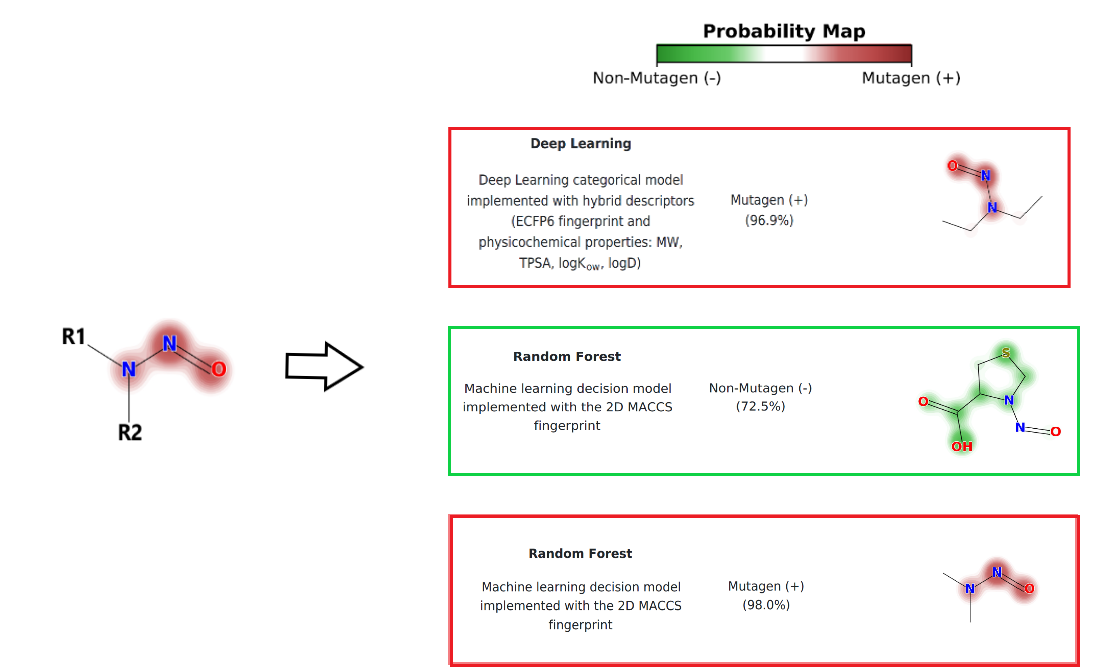
Figura 1. Avaliação de Nitrosaminas com o software Genotox-iS. O mapa de probabilidade permite obter indicativos que diferenciam nitrosaminas mutagênicas daquelas sem potencial mutagênico.
Algumas questões serão consideradas relevantes na avaliação toxicológica de perigo:
- A nitrosamina possui dados prévios de toxicidade?
- Há dados de relação dose-resposta (ex: TD50) e a extrapolação linear da TD50 para um limite com nível risco carcinogênico de 1:100.000 será considerada confiável?
- A nitrosamina formada apresenta as características estruturais sugestivas de potência e MOA (mecanismo de ação) genotóxico e carcinogênico, ou há fragmentos atenuadores?
- Em caso de insuficiência de dados, com base em estudos de Relação Estrutura-atividade (SAR) é possível determinar um limite para a nitrosamina?
Na etapa de cálculo do limite aceitável para a nitrosamina, algumas questões e diretrizes regulatórias poderão nortear a avaliação:
- O limite toxicológico pode ser calculado? Valores pragmáticos ou read-across podem ser aplicados como alternativa?
- O nível de formação da nitrosamina está abaixo do limite considerado seguro? Este limite é alcançável tecnicamente?
- Em caso de formação de mais de uma nitrosamina, o critério de decisão deve ser baseado no risco resultante ou a mera ocorrência de 2 nitrosaminas é suficiente para descontinuar o produto? (há diferentes critérios propostos pela OMS, critério do ICH M7 e critério EMA)
- Em casos de limites toxicológicos abaixo do limite técnico, o produto será descontinuado ou uma análise do risco-benefício será aplicada?
- O ajuste dos limites para posologias com duração menor que o período vital será aceita (less-than-lifetime)? (há diferentes critérios propostos pela OMS, critério do ICH M7 e critério EMA)
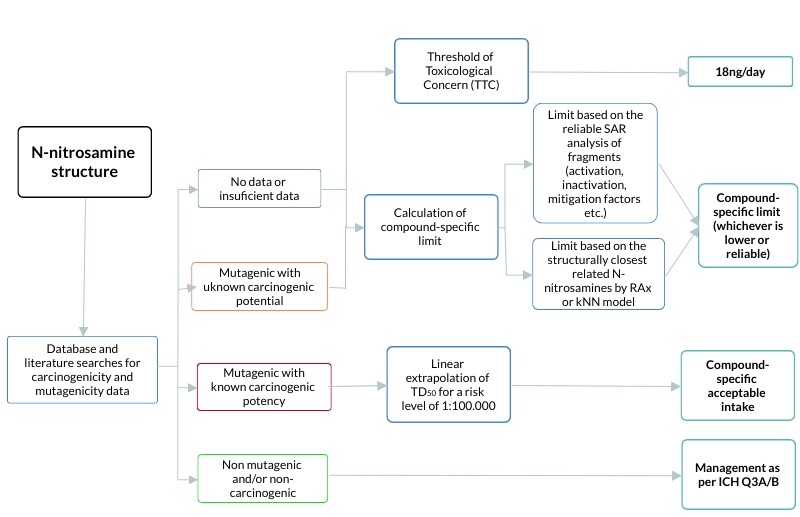 Figura 2. Algumas etapas sugeridas para a definição de limites aceitáveis para N-nitrosaminas.
Figura 2. Algumas etapas sugeridas para a definição de limites aceitáveis para N-nitrosaminas.
Longe de esgotar o tema, as respostas a estas questões e a atualização de diretrizes regulatórias serão baseadas nas experiências sendo construídas para a resolução dos principais desafios atuais. Os elementos da Toxicologia e Avaliação de Risco, base para qualquer limite toxicológico, certamente farão parte do racional de avaliação baseado no risco, como premissa para o estabelecimento de condições seguras de exposição.



